- メタボジェニック治療研究告知リーフレット
- 研究概要(メタボジェニック治療)
- 【日本語訳】当会副理事長・福沢嘉孝先生(愛知医科大学教授)への手紙
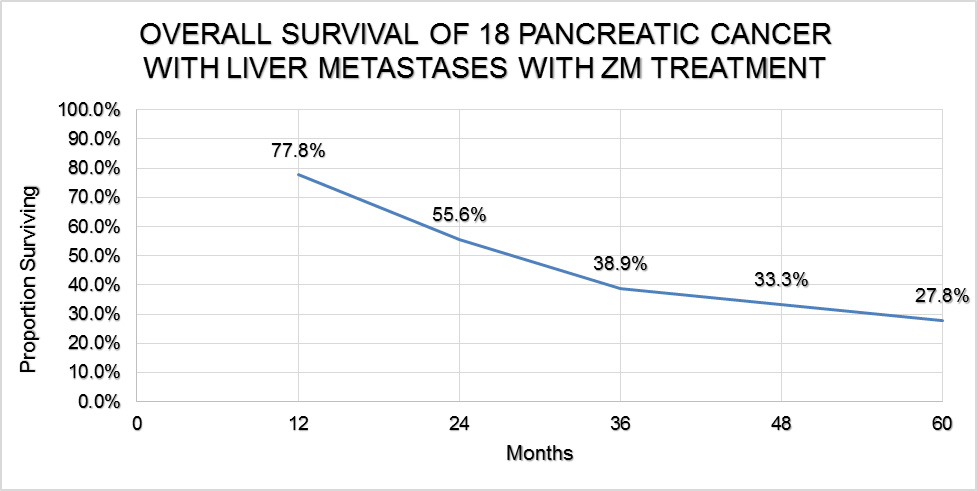
- メタボジェニック治療による肝転移を伴う膵臓ガン18症例の5年生存率(27.8%)
研究名称
ガン患者・難病患者に対する海外サプリメント(メタボジェニック製品)を使用した治癒・改善効果に関する研究
研究の概要
メタボジェニック治療の最新データで、白血病(骨髄性・リンパ性)とリンパ腫に対して、アメリカ、ベトナムで著効(数十例がオールクリア)となった新素材(BT剤)が追加され、新処方が追加とになりましたので、申込方法も変更となりました。上記のメタボジェニック治療研究の申込書類一式をプリントして、ご使用ください。
なお、固形ガンに対する処方も、白血病・リンパ腫と同様、早期(ステージ1~2期)と、進行(ステージ3~4期)とに、分ける事になりましたので、固形ガンに対する処方も、今後は、早期ガンと進行ガンで、申込内容を変更して頂くよう、お願い申し上げます。
メタボジェニック治療について
メタボジェニック治療は、ペテルブルグで物理医学を学び博士号を取得し、現在、米国南カリフォルニア大学(USC)の研究者であり、ベトナム人医師である、ドクター・バー博士が開発した治療法です。
ガン、COPDなどに対して、自然な薬草類などを配合したサプリメントや、点滴薬剤などにより、アメリカ、ベトナム、ベラルーシなど世界各国で、数多くの末期ガン患者を救ってきた実績のある治療法です。
細胞内外の代謝アンバランスやイオン交換のアンバランスなどを調整するという、まったく新しいコンセプトに基づいたの治療法により、すい臓ガンや肺ガンなど致死率の高い進行したガン患者さんを、多数救ってきた実績の報告を受け、本国(日本)でも上記と同様にガン治療に対する治療効果があるのか、治療(実臨床)の積み上げによる治療研究を多施設共同で行っています。
詳しくは、当会公式HPに、掲載した情報、
https://jscsf.org/research/cr019
及びダウンロード資料などを参照してください。
https://jscsf.org/research/cr019/documents
研究の背景、意義と必要性
ガンは1981年以降、日本人の死亡要因の第一位でありその罹患率は50%以上、死亡率は35%にも上ります。つまり日本人の2人に1人はガンに罹り、3人に1人はガンで死亡するのです。そしてガンの罹患率と死亡率は本国においては年々増加しています。ところが欧米各国では標準治療と併用した先端医療及び補完代替医療への取り組みなど効果的な統合医療の推進によって、ガンの死亡率が減少に転じています。
研究の目的
こうした状況を受けて、日本においてもガン治療に関する統合医療を推進すべく、効果的な先端医療及び補完代替医療を探索する必要性を感じます。また標準治療と先端医療及び補完代替医療を組み合わせた、統合医療の推進によって、日本でのガンの罹患率と死亡率の減少を目指します。そして最終的には、ガンを完治できる治療法の確立により、世界中に存在するガン難民の救済を図ります。
研究対象者(適格条件と除外条件)
下記の適格条件を全て満たし、除外条件のいずれにも該当しない患者を対象とします。
適格条件
- ガンと診断を受けた患者
- 未治療の患者。または標準治療で現在治療中の患者。または標準治療で改善せず現在治療を受けていない患者。または標準治療で改善せず現在補完代替療法など自由診療で治療中の患者
- 治療を受けて現在寛解しているが、再発の兆候がある患者
- 一般状態が良好(Performance Statusが0~2)である患者
【参考】ECOG_のPerformance_Status_PS__C_150_0050 - 本研究の参加にあたり十分な説明を受けた後、十分な理解の上、患者本人の自由意思による文書同意が得られた患者
- 20歳以上、80歳以下の患者(※80歳超であっても年齢相応以上に元気な患者は適格とする場合があります)
除外条件
- 本研究の研究素材に対してアレルギーの既往のある患者
- 重篤な活動性感染症を有する患者
- 治療を要する重篤な精神障害を有する患者
- 酸素非投与での動脈血酸素飽和度が94%未満の患者
- 妊婦あるいは妊娠している可能性のある患者および授乳中の患者
- その他、主治医が不適当と判断した患者
説明、同意取得の方法
本研究に参加する各施設の倫理審査委員会等で承認の得られた説明文書・同意文書を研究対象者に渡し、文書および口頭による十分な説明を行い、研究対象者の自由意思による同意を文書で得る。未成年者に関しては、代諾者でのインフォームドコンセント(文書および口頭による十分な説明を行い、研究対象者の自由意思による同意を文書で得ること、以下、「IC」という。)を行います。
研究の方法
- 研究の種類・デザイン:治療の積み上げによる観察研究(症例報告=ケーススタディ)
- 研究のアウトライン:
- 研究への参加希望者を募集し、参加希望者に(自己負担の)有償試験(問診、血液検査、尿検査、ほか)を実施し、適格条件・除外条件を判定します。
- 選ばれた研究参加者に、3か月~12か月分の研究素材(海外サプリメント及び点滴薬剤=メタボジェニック製品)を海外個人輸入により自己負担で購入して頂きます。
- 治療期間中はプロトコル(経口投与プログラム)に沿って研究素材を飲用し、当初は2週間に1回、その後1~2か月に1回の頻度で通院して一般検査と腫瘍マーカー検査など(ガンの場合。症例により検査項目は変更になります。)を測ります。
またガンの場合は3か月毎の撮影する画像診断(CT)結果を担当医師に提出します。 - 研究素材の投与終了時または終了後2週間以内に、効果測定のための検査(画像診断(CT)、腫瘍マーカー検査など)を行います。
- また投与期間中の有害事象の発生に関してはCTCAE4.0により副作用の判定を行います。
- その他、被験者自己申告、医師所見などで、健康指標の改善効果などを測定します。
- 治療効果の判定に関してはRECIST1.1に準拠して、CR(治癒・著効)/PR(部分寛解)/SD(不変)/PD(悪化)の4段階で評価・判定します。臨床研究を完了したもののプロトコル適応不十分な症例はNE(評価不能)、プロトコル逸脱または途中脱落症例はNA(適用除外)で効果判定を行います。
※NEはN数に含めま、NAはN数に含めません。
- 研究対象者の試験参加予定期間:1クール3か月または最長で4クール12か月で効果を評価します。
- 治療素材の用法・用量、投与期間投与量・投与方法および投与期間等:【ガンの場合】A剤、Cy剤、C剤の3つのサプリメントに場合によってZ剤(点滴液)を使用します。A剤は1日3回毎食前に2カプセル、C剤は1日3回毎食後2カプセルを服用します。Cy剤は最初の5日間、1日3回食事開始時に1カプセルまたは2カプセルを服用し、2日間休止して週5日間のみ服用します。Z剤は状態に応じて週5回×2週で連続10日間~最大60日間点滴を行います。Z剤の点滴は1回10mlを500mlの生理食塩水に溶かして1ドロップ1秒で約3時間掛けて滴下します。
【骨肉腫】骨肉腫に対しては上記処方に以下を追加。B15を1日3回1カプセルずつ毎食後、および、4週間Cy剤を1日3回2カプセルずつ食中に追加。
【腹水・胸水】ガンの腹水・胸水の貯留に対しては上記処方に以下を追加。P剤を1日3回2カプセルずつ毎食前に追加、I剤を1日3回2カプセルずつ毎食後に追加。
Acepton/Cytocan/Canoxの理想的な処方は、Aceptonが食前1時間から2時間前の空腹時に服用、Cytocanは食事と一緒に服用、Canoxは食事直後に服用となります。 - 試験薬の剤形・含有量、性状、包装、表示、貯法:メタボジェニックA剤、Cy剤、C剤はカプセルで、Z剤は液状です。
評価項目
- 主要評価項目(Primary Endpoint):
(RECISTガイドラインversion1.1に準拠して)単純CTによる腫瘍サイズ、腫瘍マーカー値などにより、以下の4段階で評価します。CR(消失・著効)・PR(部分寛解)・SD(不変)・PD(悪化)なおプロトコルを逸脱した場合はNE(評価不能)、追跡不可能な状態の患者はNA(適用除外)で評価。 - 副次的な評価項目(Secondary Endpoint):
・(白血球分画による)NLR(好中球/リンパ球比)の値
・単純CTによる腫瘍サイズ
・腫瘍マーカー値
などにより、その他の症状、状態の出現 - 安全性評価項目:
(CTCE4.0に準拠して)有害事象の有無
費用負担
研究対象者による費用負担(有償):
メタボジェニックA剤(60カプセル)=18,000円(2019年6月現在)
メタボジェニックCy剤(60カプセル)=15,000円(2019年6月現在)
メタボジェニックC剤(60カプセル)=16,000円(2019年6月現在)
メタボジェニックZ剤(60ml)=180,000円(2019年6月現在)
メタボジェニックP剤(60カプセル)=15,000円(2019年6月現在)
メタボジェニックI剤(60カプセル)=15,000円(2019年6月現在)
メタボジェニックG剤(60カプセル)=14,000円(2019年6月現在)
メタボジェニックL剤(30カプセル)=18,000円(2019年6月現在)
メタボジェニックV剤(30カプセル)=14,000円(2019年6月現在)
メタボジェニックF剤(60カプセル)=15,000円(2019年6月現在)
メタボジェニックT剤(60カプセル)=15,000円(2019年6月現在)
メタボジェニックB15(30カプセル)=15,000円(2019年6月現在)
メタボジェニックAs剤(60カプセル)=15,000円(2019年6月現在)
研究資金源と利益相反
本研究は、研究対象者の自己負担による症例積み上げによる観察研究であり、メーカーによる研究資金援助はありません。そのため利益相反に関する報告はありません。
研究組織
【研究実施組織】
一般社団法人日本先進医療臨床研究会(東京中央区)
研究の注意事項
- 本研究で使用する素材は海外サプリメントであり薬機法の健康被害の防止の観点からその使用は輸入者個人のみに限られており売買・譲渡は認められていません。
- 本研究素材は、形式上、サプリメント(=栄養補給)となりますので健康保険はききません。
- また税法上、サプリメント購入は治療ではないため、医療費として税金控除の対象にはなりません。
- 本研究で使用する素材は食品に分類されており、これまで健康被害の報告はありません。
- 本研究で使用する素材は飲用によるため侵襲がなく、研究対象者に行われた治療に関する症例報告の積み上げによる観察研究であるため、臨床研究保険の適用の対象とはなりません。
研究対象者および関係者からの相談への対応(窓口)
一般社団法人 日本先進医療臨床研究会(JSCSF)
(Japan Society of Clinical Study for Frontier-Medicine(JSCSF))
【事務局】〒103-0028 東京都中央区八重洲1-8-17新槇町ビル6F
TEL:03-5542-1597 FAX:03-4333-0803(電話受付:平日10時~17時)
ホームページ:https://jscsf.org/
臨床研究参加申込
※日本先進医療臨床研究会に未参加の医師・歯科医師は本臨床研究に参加することはできません。
まずはこちらのページより、日本先進医療臨床研究会への参加をお願いします。
また、企業・研究者の方などで、当会に治療素材を提供して症例の積み上げ研究を行いたいとお考えの方も同様に、当会に未参加の方は臨床研究を実施することができません。まずはこちらのページより日本先進医療臨床研究会への参加をお願いします。
また、一般の方で、当会の治療研究に参加したい方は、下記リンクより申込書をダウンロードし、必要事項をご記入の上、FAXまたはメールにて、当会宛にお申込みください。申込内容を確認の上、事務局よりご連絡させていただきます。
















