【変更前】
超高濃度(50g以上)のVC点滴や、VB17点滴は、
解糖系のATP生産を増加させ治療効果に影響を及ぼすため禁忌となります。
(同時に併用する事は推奨しません。)
↓
【変更後】
(2018年の発表)米国での研究進展により、
これまで禁忌とされていた「ジェネピック」と、
高濃度VC点滴、VB17点滴との併用の禁忌は解消され、
併用での使用可となりました。
(併用しても治療効果は落ちず、
逆に、相乗効果が認められる事が多くの症例から判明しました。)
研究名称
ガン患者に対する、海外未承認薬(複合ハーブ=ジェネピック)を使用した治癒・改善効果に関する多施設共同研究
研究の概要
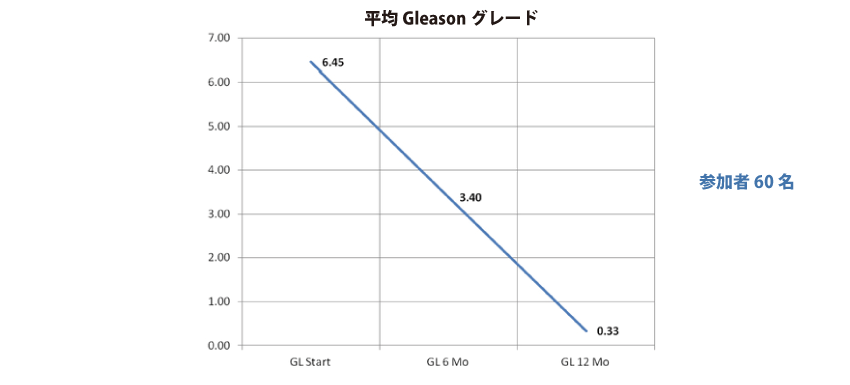
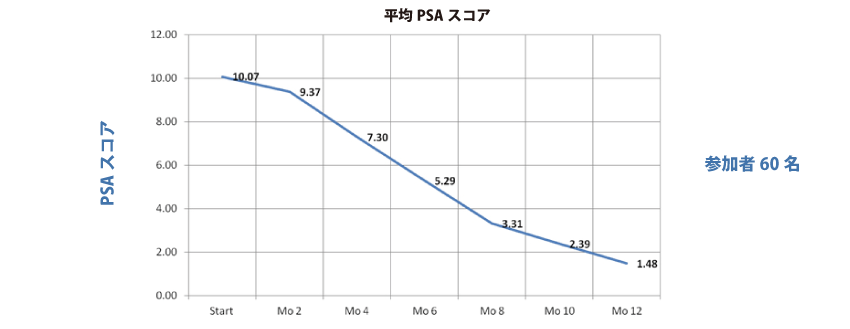
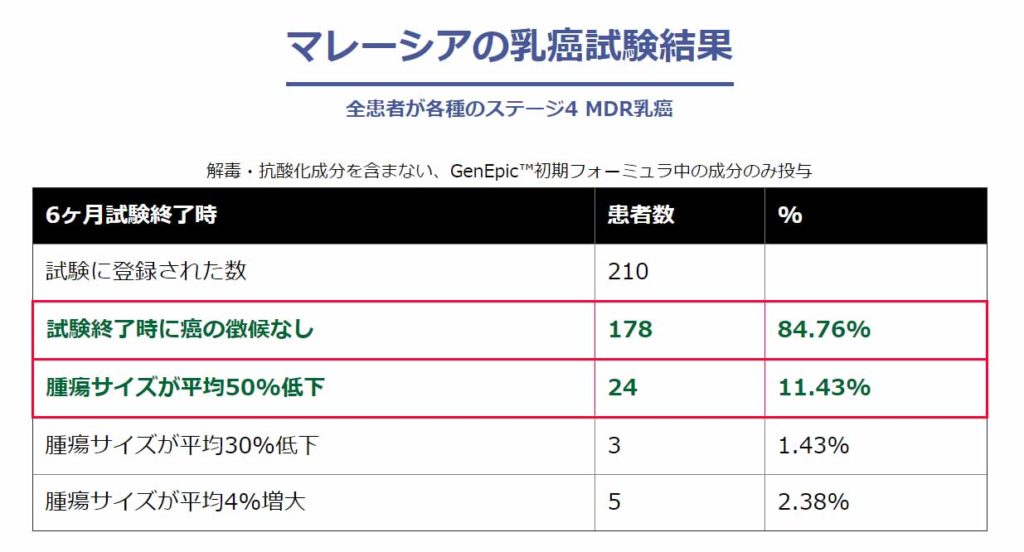
マレーシアでの治療研究(治療研究)によると、海外の複合ハーブ(ジェネピック)を使用した研究で、ステージ4 MDR(多剤耐性)乳ガンの患者210 名に対して178 名(84%)が6 ヶ月終了時にガンのない状態(消失)となり、24 名(11.43%)が平均50%の腫瘍サイズ低下が認められました。また、この報告を受けて行われた米国FDA でのフェーズ2臨床試験でも、前立腺ガン患者60 名に対して4 名を除き全員が1 年間の投与期間後に実質的にガンの徴候を示さず、CR(コンプリート・レスポンス)93.3%という驚異的な結果を見ました。
これら2 つの報告を受け、本国(日本)でも上記と同様にガン治療に対する治療効果があるのか、治療(実臨床)の積み上げによる治療研究を多施設共同で行うことにしました。





研究の背景
ガンは1981年以降、日本人の死亡要因の第一位でありその罹患率は50%以上、死亡率は35%にも上ります。つまり日本人の2人に1人はガンに罹り、3人に1人はガンで死亡するのです。そしてガンの罹患率と死亡率は本国においては年々増加しています。ところが欧米各国では標準治療と併用した先端医療及び補完代替医療への取り組みなど効果的な統合医療の推進によって、ガンの死亡率が減少に転じています。
研究の目的と必要性
こうした状況を受けて、日本においてもガン治療に関する統合医療を推進すべく、効果的な先端医療及び補完代替医療を探索する必要性を感じます。また標準治療と先端医療及び補完代替医療を組み合わせた、統合医療の推進によって、日本でのガンの罹患率と死亡率の減少を目指します。そして最終的には、ガンを完治できる治療法の確立により、世界中に存在するガン難民の救済を図ります。
研究対象者(適格条件と除外条件)
下記の条件を全て満たす患者を対象とします。
適格条件
- ガンと診断を受けた患者
- 未治療の患者。または標準治療で現在治療中の患者。または標準治療で改善せず現在治療を受けていない患者。または標準治療で改善せず現在補完代替療法など自由診療で治療中の患者。
- 一般状態が良好(Performance Statusが0~2)である患者
【参考】ECOG_のPerformance_Status_PS__C_150_0050 - 本研究の参加にあたり十分な説明を受けた後、十分な理解の上、患者本人の自由意思による文書同意が得られた患者
- 20歳以上、80歳以下の患者(※80歳超であっても年齢相応以上に元気な患者は適格とする場合があります)
除外条件
- 本研究の研究素材に対してアレルギーの既往のある患者
- 重篤な活動性感染症を有する患者
- 治療を要する重篤な精神障害を有する患者
- 酸素非投与での動脈血酸素飽和度が94%未満の患者
- 透析を必要とする腎障害患者
- 妊婦あるいは妊娠している可能性のある患者および授乳中の患者
- その他、主治医が不適当と判断した患者
説明、同意取得の方法
本研究に参加する各施設の倫理審査委員会等で承認の得られた説明文書・同意文書を研究対象者に渡し、文書および口頭による十分な説明を行い、研究対象者の自由意思による同意を文書で得る。未成年者に関しては、代諾者でのインフォームドコンセント(文書および口頭による十分な説明を行い、研究対象者の自由意志による同意を文書で得ること、以下「IC」という)を行います。
研究の方法
- 研究の種類・デザイン:治療の積み上げによる観察研究(症例報告=ケーススタディ)
- 研究のアウトライン:
- 研究への参加希望者を募集し、参加希望者に(自己負担の)有償試験(問診、血液検査、尿検査、ほか)を実施し、適格条件・除外条件を判定します。
- 選ばれた研究参加者には、6か月分または1年分の研究素材(海外未承認医薬品=複合ハーブサプリメント=ジェネピック)を、医師を通した薬監証明での海外個人輸入により自己負担で購入して頂きます。
- 治療期間中はプロトコル(経口投与プログラム)に沿って研究素材を飲用し、1か月に1回の頻度で通院して一般検査と腫瘍マーカーを測ります。また3か月毎に画像診断(CT)を測ります。
- 研究素材の投与終了時または終了後2週間以内に、効果測定ための検査(画像診断(CT)、腫瘍マーカー検査)を行います。
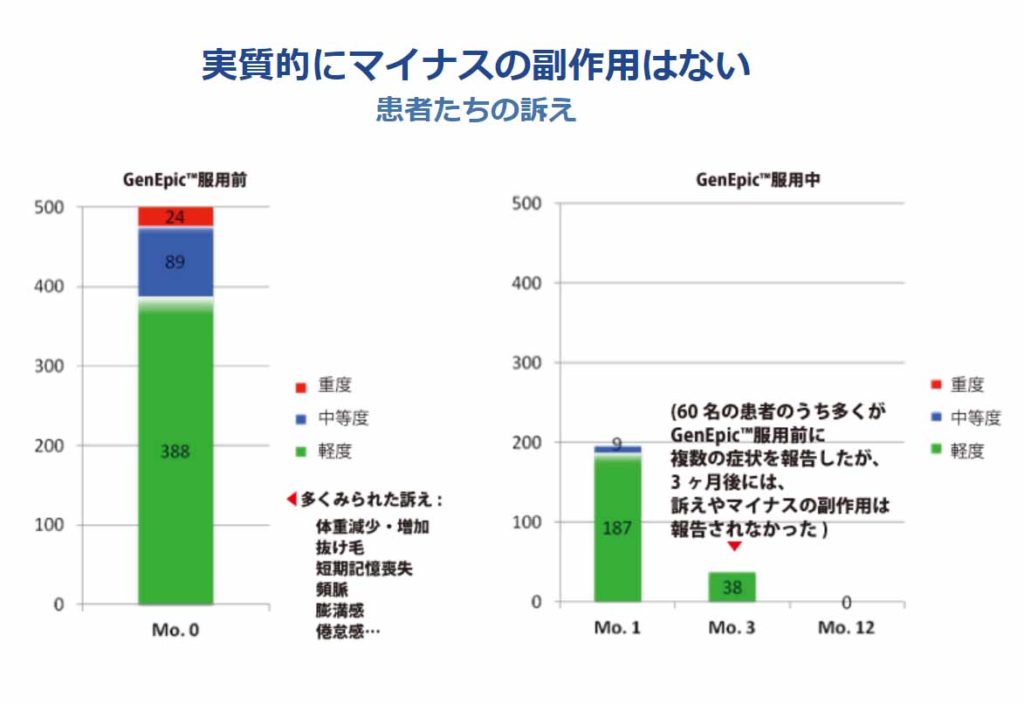
- また投与期間中の有害事象の発生に関してはCTCAE4.0により副作用の判定を行い、またSF36(Ver.2)またはEQ-5DによってQOL尺度の判定を測ります。
- その他、被験者自己申告、医師所見、などで、健康指標の改善効果などを測定します。
- 治療効果の判定に関してはRECIST1.1に準拠し、CR(治癒・著効)/PR(部分寛解)/SD(不変)/PD(悪化)の4段階で評価・判定します。臨床研究を完了したもののプロトコール適応不十分な症例はNE(評価不能)、プロトコール逸脱または途中脱落症例はNA(適用除外)で効果判定を行います。
※なおNEはN数に含めますが、NAはN数に含めません。
- 研究対象者の試験参加予定期間:1クール6か月または2クール12か月で効果を評価します。
- 試験薬の用法・用量、投与期間投与量・投与方法および投与期間等:体内動態(バイオアベイラビリティ)検査によりジェネピックの主成分であるアセトゲニンは約6時間体内に留まり排出される事が確かめられています。その為ジェネピックは6時間毎の摂取が推奨されています。そこで、ステージ1~3の患者では1日2回、朝と昼(9時、15時など)、ステージ4の患者では1日3回、朝昼晩(9時、15時、21時など)に飲用します。粉状で100種類以上の混合ハーブ薬剤(ジェネピック)を約250mlの水に溶き飲用します。
- 試験薬の剤形・含有量、性状、包装、表示、貯法:ジェネピックは粉状で100種類以上の混合ハーブ薬剤です。1回あたりの容量は約10g、主成分のアセトゲニンの量は約600mgです。
- 併用薬(療法)に関する規定:研究開始当時(2015年~2017年)は、超高濃度VC点滴、及びVB17(アミグダリン、レートリルなど)の点滴は禁忌との情報でしたが、その後、米国にて研究が進み、VC及びVB17との禁忌は解禁されました。現在は特に禁忌となる併用治療はありません。
評価項目
- 主要評価項目(Primary Endpoint):
(RECISTガイドラインversion1.1に準拠して)単純CTによる腫瘍サイズ、腫瘍マーカー値などにより、以下の4段階で評価します。
CR(消失・著効)・PR(部分寛解)・SD(不変)・PD(悪化)
なお、プロトコルを逸脱した場合は、NE(評価不能)、追跡不可能な状態の患者はNA(適用除外)で評価。 - 副次的な評価項目(Secondary Endpoint):
・(白血球分画による)NLR(好中球/リンパ球比)の値
・単純CTによる腫瘍サイズ
・腫瘍マーカー値などにより、その他の症状、状態の出現 - 安全性評価項目:
(CTCE4.0に準拠して)有害事象の出現
費用負担、健康被害の補償
研究対象者による費用負担(有償):
- ステージ1~3の患者×3か月=754,000円
- ステージ1~3の患者×6か月=1,498,000円
- ステージ4の患者×3か月=910,000円
- ステージ4の患者×6か月=1,810,000円
※本研究で使用する素材は海外未承認薬であり薬事法の健康被害の防止の観点からその使用は輸入者個人のみに限られており売買・譲渡は一切認められていません。また本研究で使用する素材は輸入元の米国では食品に分類されておりこれまで重篤な健康被害が全くなく、また本研究で使用する薬剤は飲用によるため侵襲がなく、実臨床における症例の積み上げによる観察研究であるため、臨床研究保険の適用の対象とはなりません。本臨床研究に参加希望の方は上記をご了承の上で、お問合せおよびお申込みをいただけます様、お願い申し上げます。
研究資金源と利益相反
本研究は、研究対象者の自己負担による症例積み上げによる観察研究であり、メーカーによる研究資金援助はありません。そのため利益相反に関する報告はありません。
研究組織
【研究実施組織】
一般社団法人日本先進医療臨床研究会(東京中央区)
【研究代表者】
研究代表者(医師):(兵庫医科大学教授)後藤章暢先生(兵庫) ※日本先進医療臨床研究会・会員
研究副代表者(医師):(愛知医科大学教授)福沢嘉孝先生(愛知) ※日本先進医療臨床研究会・副理事長
研究対象者および関係者からの相談への対応(窓口)
一般社団法人 日本先進医療臨床研究会(JSCSF)ジェネピック【全ガン種】研究部会
(Japan Society of Clinical Study for Frontier-Medicine(JSCSF))
【事務局】〒103-0028 東京都中央区八重洲1-8-17新槇町ビル6F
TEL:03-5542-1597 FAX:03-4333-0803(電話受付:平日10時~17時)
ホームページ:https://jscsf.org/
参考文献、参考資料
ジェネピック臨床研究について
ジェネピックの前立腺ガン試験
ジェネピックの乳ガン試験
ジェネピックの動画
研究の注意事項
- 本研究で使用する素材は海外承認薬であり薬事法の健康被害の防止の観点からその使用は輸入者個人のみに限られており売買・譲渡は一切認められていません。
- 本研究素材は、形式上、サプリメント(=栄養補給)となりますので健康保険はききません。
- また税法上、サプリメント購入は治療ではないため、医療費として税金控除の対象にはなりません。
- 本研究で使用する素材は食品に分類されており、これまで健康被害の報告はありません。
- また本研究で使用する素材は飲用によるため侵襲がなく、研究対象者に行われた治療に関する症例報告の積み上げによる観察研究であるため、臨床研究保険の適用の対象とはなりません。
- 本臨床研究に参加希望の方は、上記をご了承の上で、お問い合わせおよびお申し込みをいただけますよう、お願い申し上げます。
資料ダウンロード
- 詳細資料
- ジェネピック【全ガン種】の研究参加申込書(以下「臨床研究参加申込フォーム」を送信していただく場合は不要です)
- ジェネピック業務基本契約書
















